인공지능(AI)이 신약 개발에 큰 도움을 줄 것이라는 기대가 생긴 지 10년이 지났지만, 아직 AI가 발견한 물질 중 상용화 단계에 접어든 제품은 하나도 없다는 지적이 나왔다. 그만큼 신약 개발은 많은 난제를 가지고 있다는 것인데, 최근 알파폴드와 생성 AI의 등장으로 새로운 계기를 맞았다는 분석이다.
파이낸셜 타임스는 10일(현지시간) 2010년대 중반부터 많은 신약 개발 스타트업이 출범했지만, 아직 가시적인 성과를 거둔 곳이 없다고 지적했다. 그러나 알파폴드 등 생성 AI의 등장으로 가능성과 기대감이 다시 고조되고 있다고 소개했다. 블룸버그도 지난해 비슷한 내용을 전한 바 있다.
신약 개발은 일반적으로 10년 이상의 시간이 걸리는데, 10여년 전 연구를 시작한 AI 신약 기업들도 아직 결과물을 내놓지 못했다는 내용이다. 이 가운데 투자 회수 시기까지 겹치며 베네볼런트AI(BenevolentAI)나 엑스사이언티아(Exscientia) 등 유망 기업들이 상장 폐지되거나 다른 기업에 합병됐다. 이 과정에서 이제는 결과를 내야 한다는 압박도 커졌다고 전했다.
전문가들은 신약을 개발하는 것이 획기적인 물질을 찾아내는 것으로만 해결되지 않는다고 설명했다.
신약 개발 AI 스타트업 인시트로(Insitro)의 다프네 콜러 CEO는 인간 생물학의 복잡성 때문에 우리가 이해하지 못하는 것을 찾아내려고 애쓴다고 말했다. "신약 개발은 우주 탐사에 이어 가장 실패율이 높은 분야"라고 덧붙였다.
즉, 알고리즘의 문제를 넘어서는 근본적인 문제가 있다는 것이다. 실제 인간 세포들이 어떻게 상호작용하는지는 아직 확실하게 밝혀진 바 없다. 또 특정 증상이나 질병에 유효한 물질을 발견한다고 해도, 신체의 다른 부위에는 해를 끼치지 않도록 화합물을 설계해야 한다. 이 때문에 이론적으로는 완벽해 보이는 물질도 임상 시험에서는 90% 정도 실패하는 것으로 알려졌다.
GSK에서 30년 넘게 근무한 베테랑 화학자 대런 그린도 "신약 개발은 아마 인류가 시도하는 가장 어려운 일"이라며 "우리는 훌륭한 새로운 기술을 얻게 되는데, 그러면 또 다른 문제가 발견된다"라고 말했다.
AI는 제약 업계가 비밀을 밝혀낼 것으로 기대했던 최초의 기술은 아니다. 1950~1960년대에는 X선 결정학과 같은 도구를 사용해 단백질을 3차원으로 분석하는 구조 생물학에도 비슷한 기대가 있었다. 1980년대에는 실험을 시뮬레이션하는 계산 화학이, 2000년대 초에는 인간 유전체 발견이 뒤를 이었다.
그리고 콜러 CEO는 신약 개발이 다른 분야와는 근본적으로 다르다고 지적했다. 현재 AI 응용 사례는 대부분 "(컴퓨터) 비트와 비트가 만나는 것"이라고 말했다. 즉, 데이터를 학습해 데이터를 출력하는 형태라는 것이다.
그러나 신약 개발은 "비트와 원자가 만나는 구조"로 더욱 까다롭다고 전했다. 말로만 세계를 배운 대형언어모델(LLM)이 현실 세계를 인지하지 못하는 것과 비슷하다는 것이다.
여기에 초기에는 AI 학습에 필요한 데이터를 갖추는 것도 쉽지 않았다고 덧붙였다. 2013년 베네볼란트AI를 설립한 케네스 멀바니 창립자는 "초기 기술의 엄청난 발전 속도에 맞춰 수천개의 서로 다른 데이터베이스를 조작하고 알고리즘을 사용해 콘텐츠를 분석하고 설명하는 데 엄청난 시간을 소비했다"라고 밝혔다. 당시의 데이터셋은 비교적 작았고, 기존의 데이터를 AI 학습용으로 가공하는 데에는 엄청난 시간이 걸렸다는 것이다.
그리고 일부 기업들이 AI로 찾아낸 약물 후보들은 대부분 시중에 나와 있는 약물과 크게 다르지 않았다고 전했다.

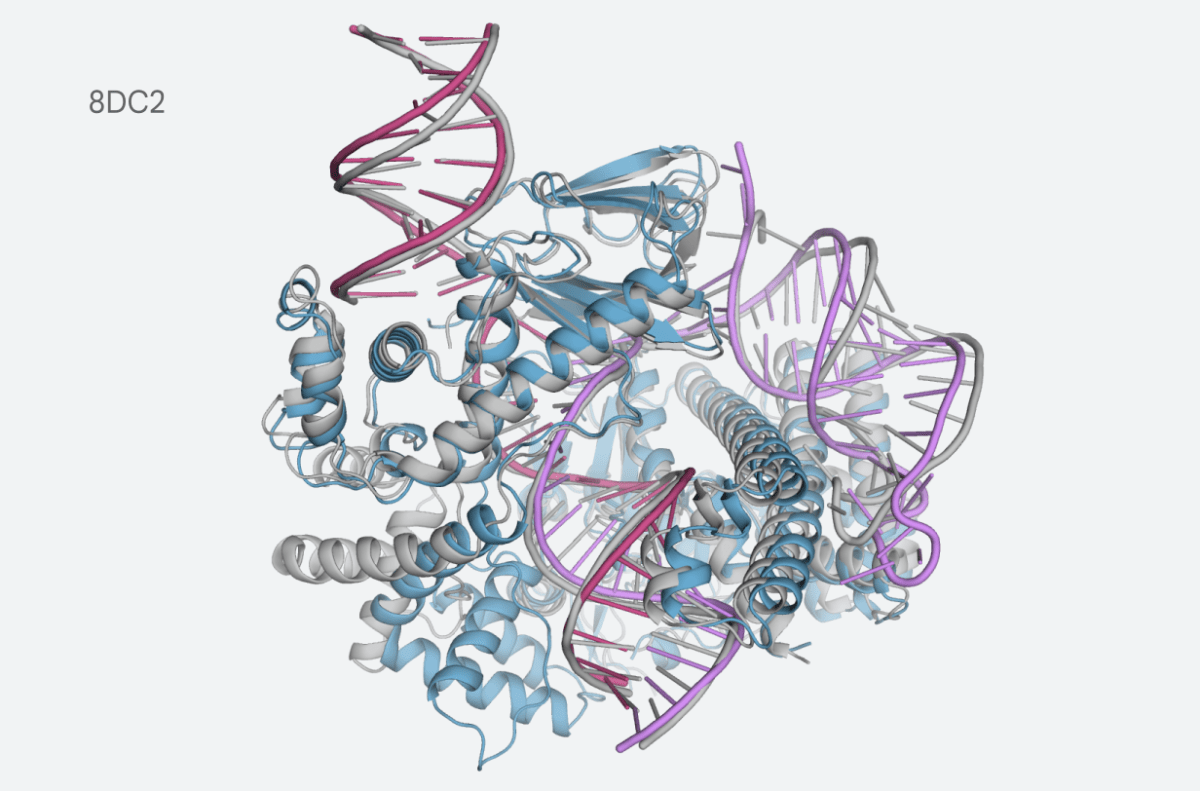
이처럼 10년 이상 신약 개발에 고전하는 중 두가지 중요한 순간이 등장했다. 하나는 구글 딥마인드가 2021년 단백질 생성 AI '알파폴드'를 출시한 것이며, 나머지 하나는 '챗GPT'의 등장으로 촉발된 생성 AI의 폭발적인 성장이다. 이때부터가 신약 개발 AI가 본격 도약하는 출발점이 됐다는 것이다.
특히 알파폴드는 알고리즘을 넘어, 이전부터 존재했던 방대하고 잘 분류된 단백질 데이터베이스를 활용할 수 있다는 것이 핵심으로 꼽혔다. 또 기존에는 약물 개발마다 다른 알고리즘을 개발해야 했으나, 알파폴드는 단백질 접힘(folding) 방식을 예측하고 과학자들이 약물 표적에 대한 이해를 높이는 데 도움을 주는 '범용 생물학 알고리즘'에 가깝다는 설명이다.
구글 자회사인 이소모픽 랩스(Isomorphic Labs)의 맥스 제이더버그 최고 AI책임자는 "알파폴드2의 출시는 획기적인 순간"이었다고 말했다. 이 회사는 알고리즘을 연구용으로 오픈 소스로 개방했다.
또 생성 AI 붐으로 인해 이제 스타트업들은 이미지 생성과 같은 기술을 약물 설계에 사용하고 있다. 구체적인 분자를 설계하는 것과 같이 이전까지 느리고 힘든 작업을 생성 AI로 처리한다는 것이다.
물론, 전문가들은 이제 신약 개발 AI가 시작 단계라고 지적한다. 진정한 신약 개발 엔진을 구축하려면 알파폴드 수준의 획기적인 발견이 대여섯개는 필요하다는 것이다. 단백질 구조뿐만 아니라 분자가 표적과 얼마나 강하게 결합하는지, 약물이 신체의 여러 부위와 어떻게 상호작용하는지, 환자의 약물 복용량이 어느 정도인지 등을 예측해야 한다는 것이다.
이 과정은 다시 몇년 또는 10년이 걸릴 수도 있을 것으로 봤다. 성급한 기대는 무리라는 지적이다.
그러나 분위기는 몇년 전과 확실히 달라졌다고 전했다. 이는 알파폴드 등장 이후 다시 투자 붐이 일었다는 것이 입증한다. 실제로 2021년에 설립된 이소모픽은 아직 임상 시험 중인 신약 후보 물질을 개발하지 못했지만, 지난 4월 투자 라운드에서 6억달러를 유치했다.
이소모픽의 CEO인 데미스 허사비스는 AI의 의미 있는 신약 임상 시험 결과가 나오지 않았다는 지적에 대해 낙관적인 입장을 밝혔다.
그는 12일 블룸버그 TV와의 인터뷰에서 "앞으로 몇년 안에 아니, 몇달 안에 신약 개발 기간이 1년 내로 줄어들 수 있을 것"이라고 말했다. 최근 그는 임상 시험용 약물을 공급하기 위한 "몇가지 초기 증거를 발견했다"라며 "아직 말하기에는 너무 이르다"라고 말했다.
또 "알파폴드의 훨씬 더 진보된 버전을 개발 중"으로, 단백질 상호작용 이상을 이해할 수 있게 될 것이라고 예고했다.
임대준 기자 ydj@aitimes.com