구글 딥마인드가 단백질 생성 인공지능(AI) ‘알파폴드(AlphaFold)’의 최신 버전을 공개했다. 첫 버전을 공개한 지 5년 만이며, 두번째 버전인 '알파폴드 2'를 내놓은 지 1년4개월여만이다.
이를 통해 새로운 유형의 다양한 분자 구조를 특성화할 수 있어 신약 발견과 같은 분야의 연구에 중요한 역할을 할 것이라는 전망도 나왔다.
테크크런치는 31일(현지시간) 딥마인드가 인체 내부의 많은 단백질 구조뿐만 아니라 더 넓은 범위의 생물학적 분자의 형태를 예측할 수 있는 최신 버전의 ‘알파폴드’를 발표했다고 전했다.
이에 따르면 새 알파폴드는 이전 버전보다 예측 기능이 대폭 향상됐다. 딥마인드는 무엇보다 ‘리간드(ligand)’의 구조를 예측하는 데 적합하다고 강조했다.
리간드는 단백질에 결합해 단백질 기능 방식에 변화를 일으킬 수 있는 분자다. 세포가 서로의 행동에 영향을 미치는 핵심 과정인 '세포 신호 전달'에서 중요한 역할을 한다.
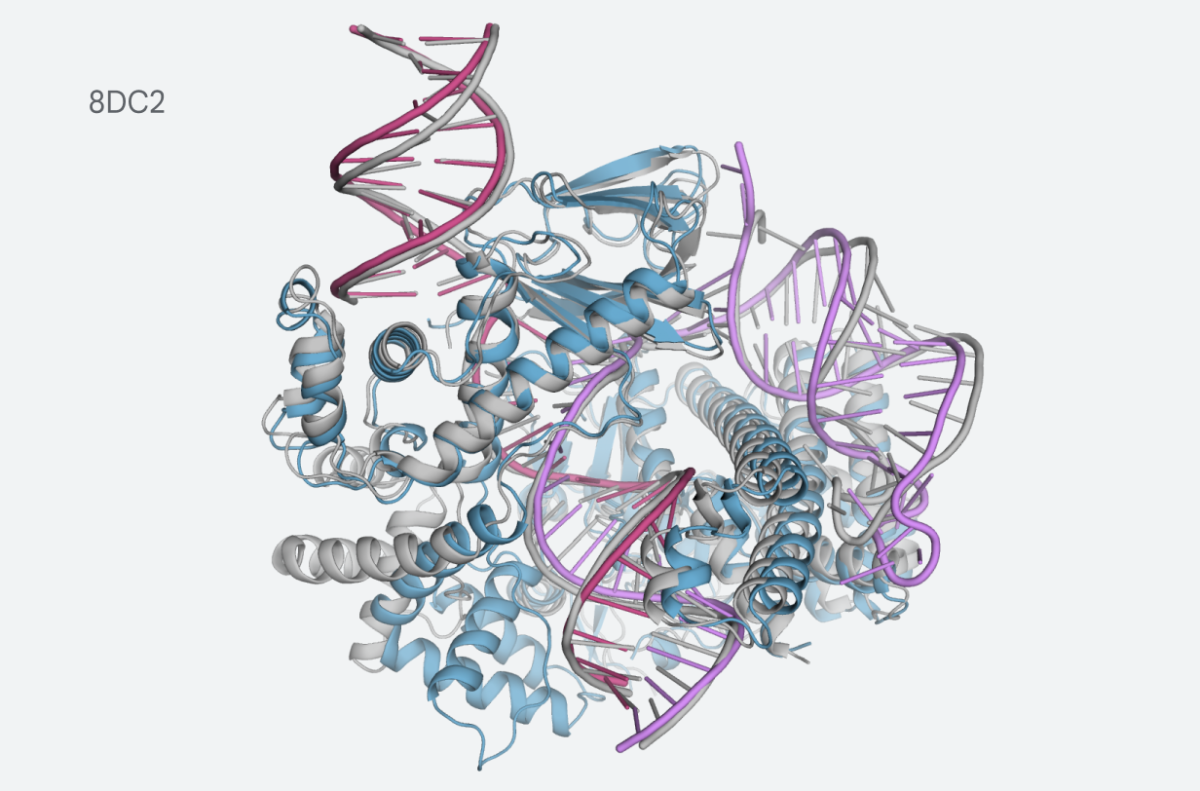
또 새 알파폴드는 DNA와 RNA를 포함하는 화합물군인 '핵산'의 분자 구조도 추정할 수 있다. 이처럼 더 많은 분자의 모양을 계산할 수 있을 뿐만 아니라 정확도도 향상됐다는 주장이다.
리간드가 단백질에 부착되거나 결합할 때 구조는 '단백질-리간드 복합체'로 알려져 있다. 전통적으로 과학자들은 도킹이라는 방법을 사용해 복합체 모양을 평가했다. 도킹법은 단백질-리간드 복합체의 단백질 성분에 대해 상당한 양의 데이터가 있는 경우에만 사용할 수 있다.
딥마인드에 따르면 알파폴드는 최고의 도킹 모델보다 단백질-리간드 복합체의 모양을 더 정확하게 예측할 수 있다. 필요한 데이터도 훨씬 적다. 따라서 과학자들은 정보가 거의 없는 새로 발견된 단백질-리간드 복합체 연구가 더 쉬워진다.
딥마인드는 알파폴드를 사용하면 세계 최대의 생물학적 분자 공개 데이터베이스인 ‘프로틴 데이터 뱅크(Protein Data Bank)’의 거의 모든 분자에 대한 예측을 생성할 수 있다고 밝혔다.
“초기 분석에서는 우리 모델이 항체 결합과 같은 약물 발견과 관련된 일부 단백질 구조 예측 문제에서 알파폴드 2보다 훨씬 뛰어난 것으로 나타났다”라며 "단백질-리간드 구조를 정확하게 예측하는 것은 과학자들이 약물이 될 수 있는 새로운 분자를 식별하고 설계하는 데 도움이 될 수 있기 때문에, 약물 발견을 위한 매우 귀중한 도구"라고 주장했다.
하지만 최신 알파폴드는 아직 완벽하지 않은 것으로 나타났다. 딥마인드는 "이 시스템이 단백질을 만들기 위한 지침을 전달하는 RNA 분자 구조를 예측하는 면에서는 다른 방법에 미치지 못한다"라고 밝혔다.
한편 단백질 생성 AI와 신약 개발용 플랫폼은 다수 기업이 경쟁을 펼치는 등 빠른 발전을 보이는 분야다. MS는 지난 9월 단백질 생성 범용 프레임워크 ‘에보디프(EvoDiff)’를 오픈 소스로 공개했으며, 구글도 5월 단백질 구조 예측 및 게놈 데이터 분석 AI 도구 2종을 출시했다. 엔비디아도 연초 '바이오네모(BioNeMo)'를 이용, 새로운 단백질 생성 AI 모델을 구축했다고 발표한 바 있다.
박찬 기자 cpark@aitimes.com
- 구글 딥마인드, 질병 유발 '유전자 변이 예측' AI 개발
- 구글 클라우드, 신약 개발 돕는 AI도구 출시
- 단백질 생성 인공지능 탄생...신약 개발의 새 지평 열린다
- "매일 전 세계 과학 논문 1만건 읽어내는 LLM 개발"
- 구글 딥마인드, 1분 만에 열흘치 날씨 예측하는 AI 개발
- 글로벌 AI 유전체학 시장, 2030년까지 연평균 50% 성장...1.5조에서 25조로 확대
- 구글, 무기화합물 생성하는 AI 공개..."신소재 220만개 예측"
- 아스트라제네카, 항암제 개발 위해 '단백질 생성 AI' 도입
- 구글 "인간이 가르쳐주지 않은 새로운 답까지 LLM이 생성"
- 구글, 단백질 생성 AI로 제약사들과 4조 규모 계약
- 엔비디아 "단백질 생성 AI로 신약 개발 가속...전문 플랫폼 확장할 것"
- 프랑스 스타트업, 최초의 '생물학 범용 모델' 개발..."단백질 생성 AI는 일부에 불과"
- 엔비디아, 10시간 만에 '알파폴드' 훈련 완료하는 '스케일폴드' 공개
- 세계 최초 AI 생성 유전자 편집기 ‘오픈크리스퍼-1’ 등장
- 구글 딥마인드, '알파폴드 3' 공개..."단백질 생성 넘어 생체 분자 예측으로 확장"